
专属客服号

微信订阅号
全面提升数据价值
赋能业务提质增效
摘要:无论国内还是国外,仿制药的进攻和原研药的防守,永远存在着激烈的竞争,但仿制药的发展是制药工业过程中必经的一条路,这也是原研药企业不得不面对的事实,在日益激烈的国际医药市场竞争,如何依据当前环境作出最好的应对,是仿制药企和原研药企都需要考虑的。
在美国FDA的定义中,仿制药是指与已批准的原研药具有生物类似性或互相替代性,与原研药在安全性、有效性、适应证、给药途径及活性成分等方面一致的仿制药品。它是在专利权属分类划分下,区别于专利药和原研药的另一种药品,仿制药的兴起源于1984年FDA通过的《药品价格竞争与专利期补偿法》。
全球仿制药规模2019年将达4099亿美元,印度发展水平居世界第一
据数据显示,2015年全球仿制药市场规模为2933亿美元,到2016年全球仿制药水平突破3000亿美元,2017年全球仿制药的市场规模超3400亿美元,截至到2018年全球仿制药市场规模为3664亿美元。由于发展中国家对仿制药的重视,全球仿制药市场迎来蓬勃发展,预计2019年全球仿制药市场将达到4099亿美元,2015年到2019年的复合增长率为8.7%,详情请见图1。其中印度生产了全球20%的仿制药,被称为“世界药房”,其国家仿制药的发展水平居世界第一,美国和日本其次,分别占据15%和7%,详情请见图2 。
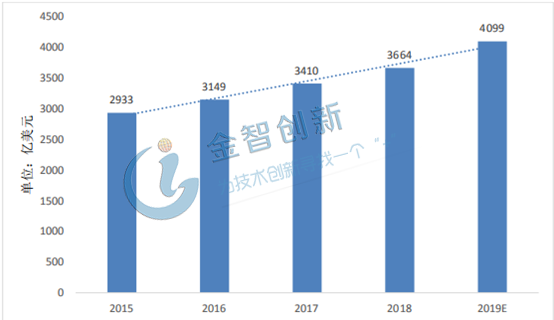
图1 2015年-2019年全球仿制药市场规模统计情况及预测
(资料来源:公开数据整理)

图2 全球仿制药市场格局
(资料来源:公开信息整理)
美国生物技术人才招聘网站BioSpace发布了全球仿制药的排行榜,其数据是以2018年企业收入为支撑,详情请见表1。美国的迈蓝以112.6亿美元的收入位居第一,在全球仿制药前十的企业中,印度占4位,分别为太阳制药、鲁宾制药、西普拉、雷迪博士,美国、以色列、日本、德国、英国和法国分别为一家。除赛诺菲和梯瓦外,其余8家公司还未有专利药上市。
表1 全球仿制药企业TOP10
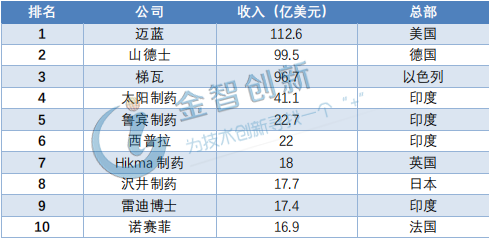
(资料来源:BioSpace)
合规、优质、高速是印度崛起的原因,药品标准和监管体系不完善是我国落后的问题所在
2018年印度生产了全球20%以上的仿制药,大约有730多亿美元的市场份额,出口到200多个国家和地区,其中生物制品和疫苗出口到150多个国家,印度仿制药60%以上都是出口到欧美日等发达国家,美国市场近40%的仿制药自印度,是名副其实的仿制药大国。
修订专利法是印度仿制药崛起的根本因素。印度《专利法》的修订,使得印度药企开始真正受益。《专利法》规定对食品、药品只授予工艺专利,不授予产品专利,这意味着印度摒弃了对药品的知识保护产权,制度上的宽松使得本国企业能够获得大量仿制药生产许可,从而为印度仿制药提供了快速扩张的空间。其他国家如加拿大、泰国、澳大利亚等未对国家的相关法规的调整,导致其国家的制药水平低于国际平均水平。
药品质量要求高是印度受到国际好评重要原因。印度能成为“世界药房”,不仅是专利法的特征,印度仿制药的质量过硬,几乎与原研药相当,在国际上得到了较高的认可。印度制药企业一方面得天独厚承袭国际大型制药企业体系,另一方面又很好延续了国际药企重视质量体系尤其是文件管理体系的建设与维护的特点。
药品审批速度快是印度抢先国际市场的保障。印度制药企业熟悉欧盟、美国的监管、市场规则,一年可以报批近50款品种。同时印度当地政策也为“印度速度”铺就康庄大道。在印度按标准建API工厂,6个月可获批邦(省)级GMP,12个月内可获批国家级GMP,15至18个月可获批cGMP,而其他国家要平均要比印度晚3到9个月。
我国仿制药的口碑恰好相反,中国仿制药龙头中华生物并未上榜全球仿制药企业TOP10,说明我国仿制药的水平还有待提高。我国仿制药国家标准、监管体系等都不尽人意。
国家标准低是我国仿制药落后的关键因素。在早前阶段,政府为了加快我国仿制药的发展,仿制药的一致性一致性评价不需要直接对标原研药,也可以是已经上市的仿制药,一致性“对标”标的物扩大导致仿制药“越仿越不像”,而且形成恶性循环,如A仿制药与原研药的一致性评价相差10%即可上市,B仿制药与A再相差10%也可上市,几轮积累下来,仿制药与原研药的药效已经不存在一致性了。美国食品和药物管理局(FDA)规定,只有在活性成分、给药途径、剂型剂量、使用条件和生物等效性上都和原研药一致,才是合格的仿制药。而中国现行的仿制药质量标准主要看活性成分和外观、性状是否和原研药相符,而对仿制药和原研药在给药途径、剂量、使用条件和临床效果上的一致性标准“仍在探索”。
监管体系不完善、造假频现是仿制药乱象杂生的起因。国仿制药审批也是槽点颇多。全中国新药批准的权力都在中国药监局的几位“决策者”手中,中国药监局也不对申请材料的真实性进行核实,对药企进行飞行抽查也从不留样品以备检测。这就让造假成为可能,不少企业直接包装原研药送检。
辅料标准的不完善是影响药品质量的关键点。任何药品的活性成分都不是单独起效的,辅料成分的变化对药品的效果也有很大影响,而我国药品辅料生产无规范,虽然出台了《药用辅料生产质量管理规范》,但这个规范既非强制认证,至今也没有实施指南,企业申报无门,实际上沦为监管方脱责的工具。
印度制药工业的迅速崛起对我国仿制药发展的启示
中印两国的制药工业在制造能力上都已进入世界大国行列,但中国的药品研发能力印度相比还有较大差距,制药工业的迅速崛起在很多方面都值得我们学习。印度仿制药“仿中有创”的“敲门砖”战略给我们很多启示。我们应向印度学习对药品的监管、相应的审批速度、严格的合规审查等,标准化的制定应向国际对齐,不能只是 “仿其形而忽其神”。
加强标准化制定,推行一致性评价。随着新版GMP对国内制药行业的调整,药企的生产水平将有整体提高,而仿制药质量一致性评价促使制药行业整体“洗牌”,全面净化药品市场,国产仿制药的竞争力越来越强,对原研药将是致命的打击。
加快药品的审批速度。我国政府目前正在逐渐重视对药品的审评审批,加快药品的上市审批速度。我国药品审评审批制度改革成效显著,新药、好药上市速度明显加快,人民群众用药需求得到更好保障。
结语
综上所述,全球仿制药规模2019年将达4099亿美元,印度发展水平居世界第一,合规、优质、高速是印度崛起的原因,而药品标准和监管体系不完善是我国落后的问题所在,我们应该向印度学习推进一致性评价的基础上,药品的生产质量需要全面向FDA认证对标,加强标准化制定,加快药品的审批速度。
本文为我公司原创,欢迎转载,转载请标明出处,违者必究!
请完善以下信息,我们的顾问会在1个工作日内与您联系,为您安排产品定制服务
评论